Каждый дачник не раз хоть что-то слышал о хелатных удобрениях, или хелатах. Но что это такое на самом деле? Чем хелатные удобрения отличаются от привычных нам минеральных удобрений? Почему использование хелатов намного эффективнее? Ведь в отдельных случаях обычные удобрения, вообще, не работают, а хелатные успешно решают проблему. Обо всем этом сегодня пойдет речь в рубрике «Вопрос-ответ» от компании «Буйские удобрения».

Вопрос: Что такое хелатная форма микроэлементов или хелаты? В чем их преимущество относительно сульфатных микроэлементов? На этот вопрос ответит начальник агрохимслужбы ОАО «Буйский химический завод» Белозёров Дмитрий Александрович
Ответ: хелатной формой микроэлементов называют соединение металлов (Fe, Zn, Cu, Mn и др.) с кислотой органического происхождения, например, этилендиаминтетрауксусной кислотой (ЭДТА) или диэтилентриаминпентауксусной кислотой (ДТПА). Существует перечень таких кислот. Они могут быть, как искусственно синтезированные (EDTA, DTPA, EDDHA и др.), так и естественного происхождения (аминокислоты), полученные методом экстракции из органического сырья.
Обычные микроэлементы, которые широко применяются в сельском хозяйстве, это минеральные соли, образованные азотной, чаще, серной кислотой. Например, железо сернокислое (железный купорос), медь сернокислая (медный купорос) – соли серной кислоты.
Главный вопрос – зачем изобретать новые препараты более сложные в производстве и более дорогие?
Рассмотрим одну из почвенных характеристик, играющую важнейшую роль в обмене веществ и влияющую на протекание химических реакций в почве – это кислотность (рН).
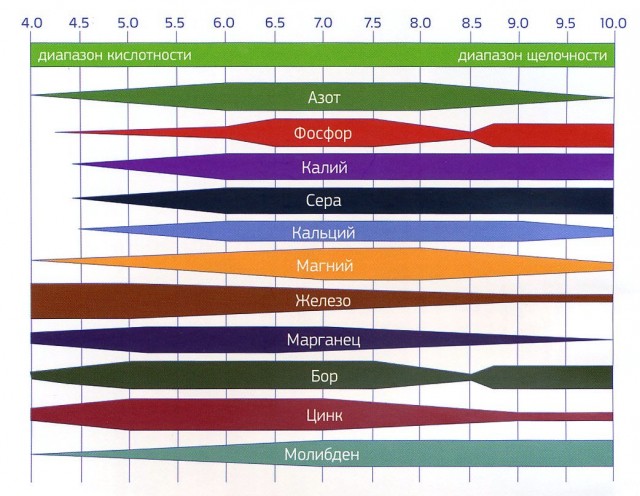
Почвы у всех разные. У кого-то кислые, где-то щелочные. Эффективность удобрений прямо зависит от кислотности.
Как мы видим на рис.1, наилучший диапазон усвоения элементов питания от 6,5 до 7,5 (максимальная ширина полосы). Это относится и к почве (почвенному раствору), и к воде (поливочному раствору). Далее в обе стороны увеличения или уменьшения рН действие макро- и микроэлементов ослабевает или совсем пропадает.
Например, на карбонатных почвах с рН от 7,5 до 8,5 усвоение фосфора и бора растениями не происходит, так как они образуют новые нерастворимые в почве соединения и становятся недоступными. И несмотря на то, что каждый год в такую почву могут вносить фосфоросодержащие удобрения (суперфосфат, аммофос, азофоска) и химический анализ почвы может показать многократное превышение допустимых норм фосфора, растения испытывают дефицит по данному элементу (данные подтверждены методами почвенной и функциональной диагностики растений).
Кислые почвы надо раскислять — известкованием, а карбонатные (щелочные) подкислять — гипсованием и стараться доводить рН до уровня 6,5-7,5.
Практически, в условиях сада-огорода это не всегда возможно реализовать. Но можно подобрать удобрения, которые «работают» в более жестких условиях.
По макроэлементам проблема решается через применение гранулированных органоминеральных удобрений (ОМУ). Органическая оболочка гранулы не дает активно взаимодействовать почвенной среде и элементам внутри гранулы, сохраняя питание для растений в любых условиях.
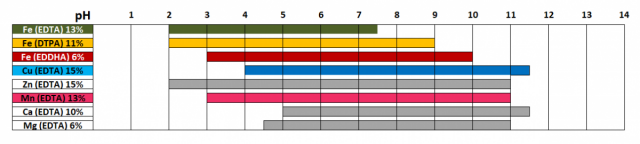
По микроэлементам – выход был найден в применении хелатных соединений, которые устойчивы в широком диапазоне рН и обеспечивают растения необходимыми металлами. Так, хелат железа ДТПА усваивается растениями в диапазоне рН 2,0-9,0, хелат цинка ЭДТА – рН 2,0-11,0, хелат меди ЭДТА – рН 4,0-11,5, хелат марганца ЭДТА – рН 3,0-11,0 (данные исследовательской лаборатории ОАО «БХЗ» по Хелатэм).
Рассмотрим механизм поведения микроэлементов в почвенном растворе (в поливочном растворе аналогично):
А) Железный купорос (сульфат железа) имеет химическую формулу FeSO4·7Н2О. При растворении в воде данное соединение распадается (диссоциирует) на положительно и отрицательно заряженные ионы Fe2+ и (SO4)2- .
В этом моменте важно знать и понимать, что растения усваивают из воды или почвенного раствора химические вещества не целиком (FeSO4·7Н2О), а только в виде катионов и ионов (Fe2+ и (SO4)2-). Между растением и внешней средой постоянно происходит ионно-катионный обмен – так растения питаются.
Поэтому, если вы готовите поливочный раствор в воде из скважины, где всегда присутствуют карбонаты, или почвы у вас карбонатные, катион железа (Fe2+), как очень активный элемент, легко образует новое соединение FeCO3 — карбонат железа.
Но он не растворим в воде (не диссоциирует), следовательно железо становится недоступным для растений. Железо из железного купороса мы потеряли!
Б) Хелат железа ДТПА имеет более сложную формулу — С14Н19FeN3NaO10. Железо соединено с органической кислотой крепкой трехковалентной связью (хелат – в переводе клешня). Попадая в почвенный раствор или в воду, молекула также распадается (диссоциирует) на ион и катион, но катионом в данном случае является не железо, а водород (Н+), а ионом с отрицательным зарядом вся оставшаяся часть молекулы С14Н18FeN3NaO10—. В таком виде железо не взаимодействует с окружающей средой, его связи закрыты, и полностью доставляется в растение.
Аналогичный механизм усвоения и у других хелатных микроэлементов.

Хелатные микроэлементы – это современные технологичные удобрения. Широко применяются в профессиональных теплицах и на полях, на всех технологиях полива и опрыскивания растений. Универсальны, эффективны и удобны в работе по всем сельскохозяйственным и декоративным культурам.











